UERJ 2014 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 31
O conjunto de elementos químicos englobados no grupo 3 e no bloco f da tabela de classificação periódica dos elementos, com exceção dos actinídeos, é denominado “metais terras raras”.
Esses metais são encontrados comumente na forma de óxidos, sendo o caráter iônico dos óxidos diretamente proporcional ao raio atômico do metal.
O metal terra rara componente do óxido de maior caráter iônico possui o seguinte símbolo:
(A) Ac
(B) La
(C) Lu
(D) Sc
Alternativa correta: (B)
O bloco f da
tabela de classificação periódica corresponde aos elementos que apresentam os
elétrons mais energéticos, situados justamente no subnível f. Fazem parte deste
bloco os lantanídeos e os actinídeos.
O grupo de
metais terras raras engloba os lantanídeos e os elementos do grupo 3, à exceção
do actínio (Ac). Observe:
O caráter iônico de um óxido de metal terra rara
aumenta em função do raio atômico do metal que o compõe. Logo, o óxido de maior
caráter iônico será aquele composto pelo metal de maior raio atômico.
Como o raio atômico é uma propriedade periódica, o
metal terra rara de maior raio atômico pode ser identificado por sua posição na
tabela de classificação periódica. Em um grupo da tabela periódica, o raio
atômico aumenta de cima para baixo, em função do aumento do número de camadas
eletrônicas. Logo, o metal terra rara de maior raio atômico no grupo 3 é o
lantânio (La).
Em um período da tabela periódica, o raio atômico
aumenta da direita para a esquerda. Isso ocorre porque, quanto menor o número
de prótons no núcleo, menor é a atração do núcleo sobre os elétrons,
aumentando-se assim o raio atômico. Dentre os lantanídeos que fazem parte do 6º
período da tabela periódica, o de maior raio atômico é o lantânio.
Com base na análise de grupos e períodos,
conclui-se portanto que o lantânio é o metal terra rara de maior raio atômico.
UERJ 2014 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 35
Uma substância orgânica possui a seguinte composição percentual em massa:
Observe outras características dessa substância:
• a razão entre o número de átomos de sua fórmula molecular e de sua fórmula mínima é igual a 2;
• o cátion liberado na sua ionização em água é o H+.
A substância descrita é denominada:
(A) ácido etanoico
(B) ácido butanoico
(C) etanoato de etila
(D) metanoato de metila
Alternativa
correta: (A)
O número de
átomos de cada elemento na fórmula mínima da substância é determinado
dividindo-se o percentual mássico pela massa atômica:
Na fórmula mínima, os átomos devem
ser indicados por números inteiros. Como os resultados acima são proporcionais,
respectivamente, a 1, 1 e 2, a fórmula mínima da substância corresponde a CH2O,
totalizando 4 átomos.
Sabe-se que a fórmula molecular tem o dobro de átomos da fórmula mínima, ou
seja, corresponde a C2H4O2. Sabe-se também que
a substância ioniza liberando cátion H+, o que significa que
ela pertence à função dos ácidos carboxílicos. O ácido carboxílico que contém
dois átomos de carbono é representado pela seguinte fórmula estrutural:
O nome desse composto é ácido
etanoico.
UERJ 2014 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 38
Considere, agora, a
adição de um átomo X na oxidação da guanina, conforme esquematizado na equação
química:
Nessa
equação, o átomo correspondente a X é simbolizado por:
(A) C
(B) H
(C) N
(D) O
Alternativa correta: (D)
Analisando-se as fórmulas estruturais das moléculas
de guanina e de guanina oxidada, observa-se que foi adicionado à segunda um
átomo de
oxigênio:
É importante notar que não há adição de átomo
de hidrogênio. O átomo de hidrogênio que estava ligado ao átomo de carbono na
guanina, e que não é representado na fórmula estrutural, passa a se ligar ao
átomo de nitrogênio na guanina oxidada.
UERJ 2014 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 40
Um laboratorista precisa preparar 1,1 kg de solução aquosa saturada de um sal de dissolução exotérmica, utilizando como soluto um dos três sais disponíveis em seu laboratório: X, Y e Z. A temperatura final da solução deverá ser igual a 20 ºC.
Observe as curvas de solubilidade dos sais, em gramas de soluto por 100 g de água:
A massa de soluto necessária, em gramas, para o preparo da solução equivale a:
(A) 100
(B) 110
(C) 300
(D) 330
Alternativa correta: (A)
A dissolução de um sal genérico AnBm pode ser
representada pela seguinte equação química:
AnBm (s)
« n A+m (aq)
+ m B-n (aq)
A dissolução em análise é um processo
exotérmico, ou seja, há liberação de energia. O aumento da temperatura favorece
as reações endotérmicas, isto é, aquelas em que há absorção de energia. Logo,
um sal com dissolução exotérmica terá sua solubilidade reduzida com o aumento
da temperatura.
Dentre os três sais disponíveis, o que apresenta dissolução exotérmica está
representado pela curva X. De acordo com essa curva, a 20 ºC, a solubilidade é
igual a 10 g de sal por 100 g de água.
Misturando-se 10 g de sal com 100 g de água, obtêm-se 110 g de solução.
Se 10 g de sal correspondem a 110 g de solução, para o preparo de 1,1 kg de
solução, tem-se:
10 g ® 110 g
M ® 1100
g M = 100 g
UERJ 2014 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 42
O nitrato, íon de geometria trigonal plana, serve como fonte de nitrogênio para as bactérias.
Observe as seguintes fórmulas estruturais:
A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número:
(A) I
(B) II
(C) III
(D) IV
Alternativa correta: (B)
A fórmula
iônica do íon nitrato é NO3- .
Em sua fórmula estrutural, os três átomos de oxigênio estão ligados ao átomo de
nitrogênio. Pela distribuição eletrônica dessas substâncias, sabe-se que o
nitrogênio apresenta cinco elétrons em sua última camada, enquanto o oxigênio
apresenta seis.
De acordo com regra do octeto, para adquirir estabilidade com oito elétrons em
sua camada de valência, o nitrogênio irá formar uma ligação dupla com o
primeiro dos átomos de oxigênio (que também irá adquirir estabilidade) e uma ligação
simples com um segundo átomo de oxigênio. Por ser um ânion de carga –1, o
nitrato contém mais um elétron dos que os presentes nos átomos participantes.
Esse elétron se liga ao segundo átomo de oxigênio, proporcionando assim sua
estabilidade.
Resta ainda o terceiro átomo de oxigênio, que necessita de dois elétrons para
alcançar a estabilidade. Como o nitrogênio já completou sua última camada, uma
ligação covalente dativa entre o nitrogênio e o terceiro oxigênio é formada,
utilizando dois elétrons livres do átomo de nitrogênio.
Com base nessas informações, a fórmula estrutural do ânion nitrato é
representada por:

UERJ 2014 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 43
O bóson de Higgs, apesar de ser uma partícula fundamental da natureza, tem massa da ordem de 126 vezes maior que a do próton, sendo, portanto, mais pesada do que a maioria dos elementos químicos naturais.
O símbolo do elemento químico cuja massa é cerca de metade da massa desse bóson é:
(A) Cu
(B) I
(C) Mo
(D) Pb
Alternativa correta: (A)
A unidade de
massa atômica (u.m.a.) é bem próxima ao valor da massa do hidrogênio. Como o
hidrogênio é constituído apenas por um próton e por um elétron, a u.m.a. também
é bem próxima ao valor da massa do próton.
Consultando-se
a tabela de classificação periódica, observa-se que a massa atômica do cobre
(Cu) é igual a 63,5 u.m.a., ou seja, corresponde a cerca de 63,5 vezes a massa
do próton, ou a cerca de metade da massa do bóson de Higgs, cuja massa vale 126
vezes a massa do próton.
UERJ 2013 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 24
O nióbio é um metal encontrado em jazidas naturais, principalmente na forma de óxidos.
Em uma jazida que contenha nióbio com número de oxidação +5, a fórmula do óxido predominante desse metal corresponde a:
(A) NbO5
(B) Nb5O
(C) Nb5O2
(D) Nb2O5
Alternativa correta: (D)
O óxido predominante na jazida tem como
cátion o nióbio com número de oxidação +5:
Nb+5
Como se trata de um óxido, o ânion é o
oxigênio com número de oxidação -2:
O-2
Dessa forma, o óxido em questão tem a
seguinte fórmula química:
UERJ 2013 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 26
Admita que as soluções depositadas em R1 e R2 até o instante t = 40 s tenham sido misturadas em um novo recipiente, formando uma solução neutra.
Sabendo que a concentração inicial da solução ácida é igual a 0,10 mol.L-1, a concentração inicial da solução básica, em mol.L-1, corresponde a:
(A) 0,10
(B) 0,15
(C) 0,20
(D) 0,25
Alternativa correta: (B)
Após 40 s, o
volume de solução aquosa de ácido clorídrico de concentração 0,10 mol.L 1 depositado em R1 corresponde
a V.
O volume de
solução aquosa de hidróxido de sódio depositado em R2 em 40 s é determinado a partir de uma
relação de proporcionalidade, pois sabe-se que em 60 s, o volume equivale
a V:
A reação
química entre o ácido clorídrico e o hidróxido de sódio é representada por:
HCl +
NaOH ® NaCl
+ H2O
Dessa
equação, pode-se constatar que a proporção estequiométrica entre ácido e base é
de 1:1. Logo, há equivalência quando o número de mols de HCl (nA) é
igual ao número de mols de NaOH (nB):
nA = nB
Em uma
solução, o número de mols é igual ao produto da concentração em quantidade de
matéria (C), em mol . L-1, pelo
volume (V), em litros:
CA.VA = CB.VB
Substituindo
os valores, tem-se:
UERJ 2013 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 29
Substâncias com calor de dissolução endotérmico são empregadas na fabricação de balas e chicletes, por causarem sensação de frescor. Um exemplo é o xilitol, que possui as seguintes propriedades:
Considere M a massa de xilitol necessária para a formação de 8,04 g de solução aquosa saturada de xilitol, a 25 oC.
A energia, em quilocalorias, absorvida na dissolução de M corresponde a:
(A) 0,02
(B) 0,11
(C) 0,27
(D) 0,48
Alternativa correta: (B)
Como a
solubilidade corresponde a 60,8 g de xilitol em 100 g de água, a massa de
solução saturada contendo 60,8 g de xilitol é igual a: 60,8 + 100 = 160,8 g.
Portanto, a massa M de xilitol em 8,04 g de solução pode ser calculada a partir
da relação:
Como a massa
molar do xilitol é igual a 152 g.mol-1, a quantidade de matéria
presente em 3,04 g corresponde a:
Como a
entalpia de dissolução do xilitol é igual a 5,5 kcal.mol-1, a
energia liberada por 0,02 mol dessa substância é dada por:
UERJ 2013 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 31
Uma indústria fabrica um produto formado pela mistura das quatro aminas de fórmula molecular C3H9N.
Com o intuito de separar esses componentes, empregou-se o processo de destilação fracionada, no qual o primeiro componente a ser separado é o de menor ponto de ebulição.
Nesse processo, a primeira amina a ser separada é denominada:
(A) propilamina
(B) trimetilamina
(C) etilmetilamina
(D) isopropilamina
Alternativa correta: (B)
As quatro
aminas de fórmula molecular C3H9N são:
A primeira
amina a ser separada por destilação fracionada é aquela de menor ponto de
ebulição. Quando se analisa uma mistura de isômeros, o principal fator que
diferencia o ponto de ebulição desses isômeros é o tipo de interação
intermolecular. A interação intermolecular mais forte é a ligação de
hidrogênio, que é formada entre um átomo muito eletronegativo, no caso o
nitrogênio, e o átomo de hidrogênio, que se encontra ligado a um átomo muito
eletronegativo, novamente o nitrogênio. Observe:
N.....H–N
Como a trimetilamina é a única amina que não apresenta átomos de hidrogênio
ligados ao nitrogênio, esses átomos não formam ligações de hidrogênio, de forma
que essa é a amina de menor ponto de ebulição.
UERJ 2013 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 32
Denomina-se beta-oxidação a fase inicial de oxidação mitocondrial de ácidos graxos saturados.
Quando esses ácidos têm número par de átomos de carbono, a beta-oxidação produz apenas acetil-CoA, que pode ser oxidado no ciclo de Krebs.
Considere as seguintes informações:
• cada mol de acetil-CoA oxidado produz 10 mols de ATP;
• cada mol de ATP produzido armazena 7 kcal.
Sabe-se que a beta-oxidação de 1 mol de ácido palmítico, que possui 16 átomos de carbono, gera 8 mols de acetil-CoA e 26 mols de ATP.
A oxidação total de 1 mol de ácido palmítico, produzindo CO2 e H2O, permite armazenar sob a forma de ATP a seguinte quantidade de energia, em quilocalorias:
(A) 36
(B) 252
(C) 742
(D) 1008
Alternativa correta: (C)
Sabe-se que
o ácido palmítico possui 16 carbonos e que 1 mol desse ácido gera 8 mols de acetil-CoA e 26 mols de ATP na
beta-oxidação. Por sua vez, cada mol
de acetil-CoA produz 10 mols de ATP quando oxidado no ciclo de Krebs.
Portanto, 8 mols de acetil-CoA oxidados
produzirão 8 × 10 = 80 mols de ATP. Considerando a beta-oxidação do
ácido palmítico e a oxidação dos 8 mols de acetil-CoA no ciclo de Krebs, a quantidade total de mols de ATP formado
será igual a 26 + 80 = 106 mols de ATP. Como cada mol de ATP armazena 7 kcal, 106 mols armazenarão 106 × 7 = 742 kcal.
UERJ 2013 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 34
O aspartame, utilizado como adoçante, corresponde a apenas um dos estereoisômeros da molécula cuja fórmula estrutural é apresentada abaixo.

Admita que, em um processo industrial, tenha-se obtido a mistura, em partes iguais, de todos os estereoisômeros dessa molécula.
Nessa mistura, o percentual de aspartame equivale a:
(A) 20%
(B) 25%
(C) 33%
(D) 50%
Alternativa correta: (B)
A condição
básica de ocorrência de isomeria óptica é a presença de átomo de carbono
assimétrico na molécula. O átomo de carbono assimétrico é aquele ligado a
quatro grupamentos distintos. Na molécula de aspartame, estão presentes dois
átomos de carbono assimétrico, os quais se encontram indicados na estrutura a
seguir:
O número de esteroisômeros (isômeros oticamente ativos) corresponde a 2n, sendo n o número de átomos de carbono
assimétrico diferentes presentes na molécula. Como n = 2, tem-se 22 = 4
estereoisômeros. Como os isômeros estão presentes em quantidades iguais, o
percentual de aspartame (um dos isômeros) é calculado por:
UERJ 2012 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 23

Suponha que, em alguns dos locais atingidos pela radiação, as pastilhas disponíveis continham, cada uma, 5 x 10−4mol de iodeto de potássio, sendo a dose prescrita por pessoa de 33,2 mg por dia. Em razão disso, cada pastilha teve de ser dissolvida em água, formando 1L de solução.
O volume da solução preparada que cada pessoa deve beber para ingerir a dose diária prescrita de iodeto de potássio corresponde, em mililitros, a:
(A) 200
(B) 400
(C) 600
(D) 800
Alternativa
correta: (B)
A massa
molar do iodeto de potássio (KI) é igual a soma das massas molares do potássio
e do iodo:
39 + 127 = 166 g
Sabendo que uma pastilha prescrita contém 5 x 10-4 mol de KI, pode-se calcular a massa de
KI presente em cada uma:
1
mol ® 166 g
5 x 10-4 mol ®
X
X = 0,083 g = 83 mg
Como essa foi a quantidade de massa de KI dissolvida, a concentração
de 1 L de solução formada é igual a 83 mg.L-1.
O volume de solução que contém 33,2 mg de KI corresponde a:
83 mg ® 1 L
33,2 mg ® Y
Y = 0,4 L = 400 mL
O volume de solução a ser ingerido é igual a 400 mL.
UERJ 2012 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 26
Na indústria de alimentos, a análise da composição dos ácidos carboxílicos não ramificados presentes na manteiga é composta por três etapas:
- reação química dos ácidos com etanol, formando uma mistura de ésteres;
- aquecimento gradual dessa mistura, para destilação fracionada dos ésteres;
- identificação de cada um dos ésteres vaporizados, em função do seu ponto de ebulição.
O gráfico a seguir indica o percentual de cada um dos ésteres formados na primeira etapa da análise de uma amostra de manteiga:

Na amostra analisada, está presente em maior quantidade o ácido carboxílico denominado:
(A) octanoico
(B) decanoico
(C) hexanoico
(D) dodecanoico
Alternativa correta: (C)
A
partir do gráfico, constata-se que o éster formado em maior quantidade tem
fórmula molecular C8H16O2.
Esse éster é formado pela reação entre um ácido
carboxílico e o etanol, cuja fórmula molecular é C2H6O.
Essa reação pode ser representada pela seguinte equação:
ácido +
etanol ®
éster + água
CxHyOz
C2H6O
C8H6O2
H2O
Com base nessa equação, o ácido carboxílico não
ramificado em maior quantidade na amostra é o de fórmula molecular C6H12O2,
denominado ácido hexanoico.
UERJ 2012 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 28
No interior do casco dos navios, existem tanques que podem ter seu volume preenchido parcial ou totalmente com água do mar em função das necessidades de flutuabilidade.
Como os tanques são constituídos de materiais metálicos, eles sofrem, ao longo do tempo, corrosão pelo contato com a água do mar, conforme a equação:
Um processo corrosivo no interior de um tanque fechado apresenta as seguintes características:
Admita que, durante todo o processo de corrosão, o ar no interior do tanque esteve submetido às CNTP, com comportamento ideal, e que apenas o oxigênio presente no ar foi consumido.
A massa de ferro, em quilogramas, consumida após o processo corrosivo foi igual a:
(A) 1300
(B) 1600
(C) 2100
(D) 2800
Alternativa
correta: (B)
A variação
da concentração percentual de gás oxigênio no interior do tanque ao longo do
processo corrosivo corresponde a:
20,9 - 19,3 = 1,6%
O volume de oxigênio consumido no processo de corrosão do ferro consiste em
1,6% do volume de ar no interior do tanque. Logo:
30.000 m3 x 1,6/100 =
480 m3 = 4,8 x 105 L
A equação química balanceada indica que 3 mols de O2 demandam o consumo de 4 mols de Fe.
Portanto, a massa de Fe consumida por 4,8 x 105 L de O2 será:
4 x 56 g ® 3 x 22,4 L
X ® 4,8 x 105 L
X = 1,6 x 106 g = 1600
kg
A massa de ferro consumida foi igual a 1600 kg.
UERJ 2012 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 30
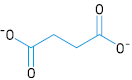
Em uma das etapas do ciclo de Krebs, ocorre uma reação química na qual o íon succinato é consumido. Observe a fórmula estrutural desse íon:
Na reação de consumo, o succinato perde dois átomos de hidrogênio, formando o íon fumarato.
Sabendo que o íon fumarato é um isômero geométrico trans, sua fórmula estrutural corresponde a:
 |
| (A) |
 |
| (B) |
 |
| (C) |
 |
(D)
Alternativa correta: (D)
O íon
fumarato é formado a partir da remoção de dois átomos de hidrogênio do
succinato. A perda de dois átomos de hidrogênio acarreta a formação de uma
ligação dupla. Com base nestas informações, e sabendo que o íon fumarato é um
isômero geométrico trans, sua fórmula estrutural espacial corresponde a:
UERJ 2012 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 37
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3.
Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
(A) HCl
(B) NaCl
(C) NaOH
(D) NaHCO3
Alternativa
correta: (B)
Dissolvendo-se
as substâncias disponíveis no laboratório em água, chega-se às seguintes
conclusões:
HCl  H+ + Cl- H+ + Cl-
O meio torna-se ácido devido à liberação de íons H+.
NaCl ® Na+ + Cl-
O meio permanece neutro pois não são formados íons H+ ou OH-.
NaOH ® Na+ + OH-
O meio fica básico devido à liberação de OH-.
NaHCO3 ® Na+ + H++ CO32-
O meio fica ácido devido à liberação de H+.
Dentre essas substâncias, duas são sais, NaCl e NaHCO3,
sendo que apenas o NaCl acarreta a formação de uma solução com pH neutro.
Logo, a substância a ser escolhida é o NaCl.
UERJ 2012 - 1o. EXAME DE QUALIFICAÇÃO - QUESTÃO 41
O monóxido de carbono, formado na combustão incompleta em motores automotivos, é um gás extremamente tóxico. A fim de reduzir sua descarga na atmosfera, as fábricas de automóveis passaram a instalar catalisadores contendo metais de transição, como o níquel, na saída dos motores.
Observe a equação química que descreve o processo de degradação catalítica do monóxido de carbono:
Com o objetivo de deslocar o equilíbrio dessa reação, visando a intensificar a degradação catalítica do monóxido de carbono, a alteração mais eficiente é:
(A) reduzir a quantidade de catalisador
(B) reduzir a concentração de oxigênio
(C) aumentar a temperatura
(D) aumentar a pressão
Alternativa correta: (D)
Para reduzir
a concentração de monóxido de carbono (CO) no processo, o equilíbrio químico
deve ser deslocado no sentido de consumi-lo, ou seja, da esquerda para a
direita.
2 CO (g) + O2 (g) « 2 CO2 (g) ∆H = -283 kJ.mol-1
De acordo com o princípio de Le Chatelier, quando
se aumenta a pressão no interior de um sistema, o equilíbrio é
deslocado no sentido de menor volume. Como os reagentes ocupam 3 volumes em
relação aos 2 volumes ocupados pelo produto, com o aumento da pressão, o
equilíbrio químico será deslocado no sentido direto.
Assim, para
se reduzir a concentração de CO, deve-se aumentar a pressão.
|